一、米氏方程
过渡态稳定学说-中间络合物学说(补充知识点):

米氏方程(常作为计算题考点),酶促反应曲线为典型的双曲线。(常作为填空题题考点,不需要知道推导过程)

(1)Km就是米氏常数,为米氏酶的特征常数。当[S]=Km时,v0=Vmax/2。由此可以看出Km值的物理意义,即Km值是当酶反应速率达到最大反应速率一半时的底物浓度,单位是mol·L-1(名词解释考点),与底物浓度的单位一样。对于遵守米氏动力学的反应,Km是酶发生有效催化时,对所需底物浓度的一种尺度,即具有高Km的酶比具有低Km的酶需要更高的底物浓度才能到达给定的反应速率。(Km越大,亲和力越小)
(2)[S]表示底物浓度。
(3)Vmax表示当酶被完全饱和时,酶促反应的最大速率。

(4)当[S]>>Km时

(5)当[S]<<Km时

二、动力学参数
动力学参数的意义
Ⅰ.Km
(1)Km是酶的一个特性常数:Km的大小只与酶的性质有关,而与酶浓度无关。Km值随测定的底物、反应的温度,pH及离子强度而改变(判断题、填空题考点)。因此,Km值作为常数只是对一定的底物、pH、温度和离子强度等条件而言。故对某一酶促反应而言,在一定条件下都有特定的Km值,可用来鉴别酶(可以理解为Km是亲和力的量度,对于不同底物酶的亲和力不同,在不同温度和pH下酶的性质不同所以亲和力会发生改变)。
(2)Km值可以判断酶的专一性和天然底物:有的酶可作用于几种底物,因此就有几个Km值,其中Km值最小的底物称为该酶的最适底物也就是天然底物。1/Km可近似地表示酶对底物亲和力的大小,1/Km愈大,表明亲和力愈大,因为,1/Km愈大,则Km愈小,达到最大反应速率一半所需要的底物浓度就愈小(判断题考点)。显然,最适底物时酶的亲和力最大,Km最小。
(3)若已知某个酶的Km值,就可以计算出在某一底物浓度时,其反应速率相当于Vmax的百分率。(常作计算题考点)
(4)当k2>>k3(ES分解生成产物的速度不足以破坏E和ES之间的快速平衡)(Ks越大表明亲和能力越弱,解离程度越高)时,Km=Ks(ES的解离常数),即Km等于ES复合物的解离常数(底物常数),可以作为酶和底物结合紧密程度的一个度量,表示酶和底物结合的亲和力大小(在不知道Km确实等于Ks之前,用Km表示酶和底物的亲和力是不确切的)。
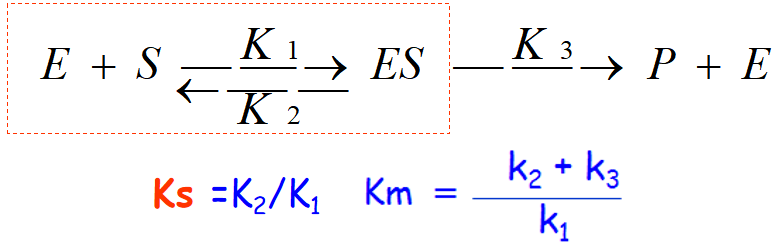
(5)Km值可以帮助推断某一代谢反应的方向和途径,催化可逆反应的酶,对正逆两向底物的Km值是不一样的(如果酶对底物的Km值小于对产物的Km值,则反应有利于正反应。否则,有利于逆反应)。
Ⅱ.Vmax和kcat
Vmax和kcat(催化常数)的意义:在一定酶浓度下,酶对特定底物的Vmax(Vmax=k3*E0,k3代表酶饱和时[ES]→P+E的速率常数,E0代表此时的酶量)也是一个常数。Vmax与Km相似,同一种酶对不同底物的Vmax也不同。pH、温度和离子强度也影响Vmax的数值。kcat(k3)也称为酶的转换数(TN),它是酶的最大催化活力的量度。TN定义为:当酶被底物饱和时每秒钟每个酶分子或每个活性部位(对多亚基酶而言)将底物转换为产物的分子数,转换数也称为分子活力。(常作计算题和名词解释)

酶的转换数算法:酶的比活力=酶活力/蛋白量(mg),转换数是每秒每个酶分子转换底物的分子数,或者每秒每微摩尔酶转换底物的微摩尔数。转换数=酶活力/微摩尔数,微摩尔数=蛋白量/相对分子质量。所以,转换数=比活*相对分子质量。
Ⅲ.kcat/Km
该值的大小可以用于比较不同酶或同一种酶催化不同底物的催化效率,也称为专一性常数。可以表示一个酶的催化效率或者完美程度。大的kcat和(或)小的Km将给出大的kcat/Km值。
作图法测定Km和Vmax。(其他作图方式了解即可,重点是L-B作图法)
(1)Lineweaver-Burk双倒数作图法将米氏方程式两侧取双倒数。(常作填空题、选择题考点)(横坐标和纵坐标需要记忆)(优点是使用方便,Vmax和Km都较容易求,缺点是实验得到的点一般集中在直线的左端)


(2)Eadie-Hofstee作图法(优点是求Km比较方便,缺点是作图前计算较繁)

![]()
(3)Hanes-Woolf作图法(优点是求Km比较方便,缺点是作图前计算较繁)

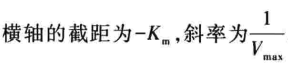
(4)Eisenthal和Cornish-Bowden 直接线性作图法(最好的一种方法,不需计算,作图方便,结果准确)

![]()
多底物的酶促反应动力学(了解即可,米氏方程适用于单底物和单产物)
(1)序列反应:底物的结合和产物的释放有一定的顺序,产物不能在底物完全结合前释放。A和B底物二者均结合到酶上,然后反应产生P和Q。
![]()
①有序反应:反应在A和B之间产生三元复合物,随后有序的释放反应产物P和Q。(例:需要NAD+或NADP+的脱氢酶)

②随机反应(例:肌酸激酶)

(2)乒乓反应:这类反应的特点是,酶同A的反应产物(P)是在酶同第二个底物B反应前释放出来,作为这一过程的结果,酶E转变为一种修饰酶形式E',然后再同底物B反应生成第二个产物Q,和再生为未修饰的酶形式E。(例:氨基转移酶)


