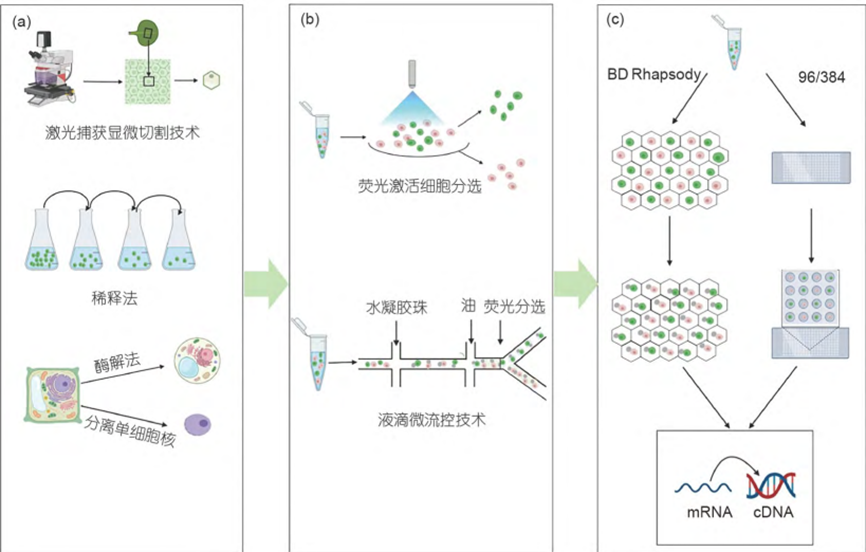
单细胞分离是从待分离的材料中分离出单个细胞的过程。获得单个细胞样品是进行单细胞测序的第一步。分离植物单个细胞常用的方法有酶解法、分离单细胞核、激光捕获显微切割技术、荧光激活细胞分选技术、稀释法、液滴微流控技术、BD Rhapsody微孔捕获技术等。
一、酶解法
常用于制备原生质体,可以快速得到大量的原生质体,常用的酶有纤维素酶R-10、离析酶R-10和果胶酶Y-23。
优点:
后续测序获得的数据较完整,获得的信息较全面。
缺点:
在原生质体制备过程中,消化细胞壁的酶,容易导致细胞出现应激反应诱导基因过度表达;不同植物、不同组织乃至不同类型细胞的酶解条件可能都不一样,同一酶解条件难以适用于不同的样本,所以对于不同的物种、组织、细胞需要调整不同的酶解条件;制备的原生质体比较脆弱,同样也需要调整不同的保存方案。
二、分离单细胞核法
目前最常用的方法是将样品切碎,放入细胞核分离缓冲液(nuclearisolationbuffer,NIB)中培养,释放细胞核。
优点:
细胞核分离相比于原生质体制备的优势在于更容易被分离,避免了由于酶促解离而导致的转录组变化;分离原生质体需要新鲜的样本,但细胞核分离可用于保存的冰冻标本等,实验材料更加广泛。
缺点:
由于少了细胞质内的转录组信息,后续测序获得的数据相对单细胞转录组测序的少;分离单个细胞核的方法也不全适用于各种植物。
三、激光捕获显微切割(laser-capturemicrodissection,LCM)技术
在不破坏组织结构、保存要捕获的细胞和其周围组织形态完整的前提下,直接采用冰冻切片或石蜡包埋方法从组织切片获取目标细胞。
优点:
能精准地分离出目标细胞。
缺点:
单细胞分离通量较低,激光捕获切割方法通常对样本进行石蜡包埋或冷冻固定,这些固定剂通常会对样本的RNA产生影响。
四、荧光激活细胞分选技术(fluorescence-activatedcellsorting,FACS)
通过流式细胞仪,依据细胞的特异性物质或细胞光散射特性选出单个细胞。
优点:
FACS检测速度极快,每秒可以检测数千至上万的细胞,分离纯度可达99%以上。
缺点:
机器中的快速流动和非特异性荧光分子会损害分选细胞(阳性细胞)的生存能力从而导致分离失败。FACS要求悬浮液起始细胞数量较多(超过10000个细胞),不能从低数量的细胞群中分离出单细胞,不适合稀有细胞的分选。需要解离组织,使细胞功能和细胞间相互作用以及组织结构的丧失。
五、稀释法
使用手动移液器或移液机器人来稀释细胞悬液分离单个细胞,高度稀释样品中的细胞数量可以低至每分装一个细胞。
优点:
操作简单、不需要特殊的设备、成本较低。
缺点:
只能分离出生物群体中数量较多的种类,分离成功率较低。由于过程的统计性质和对单个细胞的控制不足,往往需要进一步的下游技术来证明特定井中单个细胞的存在。
六、液滴微流控技术液滴分选
将水相的细胞悬浮液与带有条形码DNA引物的HBs先于微流控芯片中结合再与油相汇聚,两种互不相溶的两种流体在结合的瞬间,将水相的单细胞包裹在液滴中(每一个细胞与一个HB包裹在同一液滴)封装到纳升反应腔中,从而达到分离单细胞的效果。
优点:
该技术可以在短时间内产生大量的液滴,而且可以为单细胞分析提供独立的分室,以防止交叉污染。细胞通量高、建库周期较短、操作简单。
缺点:
对样本的活性要求高,适用于直径小于40 μm的细胞.。
七、BD Rhapsody 微孔捕获技术
BD Rhapsody 是一种基于微孔的技术BD采用蜂窝板技术(>2×105的微孔),充分保证了一个孔一个细胞。单个细胞在重力的作用下随机沉积到皮升井中,将含有细胞条形码和UMI的磁珠加载到微孔阵列上,使其充满大多数的皮升井。之后细胞裂解释放的mRNA与磁珠上条码标记的捕获寡核苷酸杂交,这些磁珠被收集起来进行逆转录、扩增和测序。
优点:
避免了10×Genomics中存在的概率碰撞影响捕获效率的问题,对样本活性要求较低。
缺点:
操作步骤较多,适用于直径20μm以下的细胞,对于直径较大的细胞有局限性。
(a) 单细胞/单细胞核制备 (b) 单细胞/单细胞核分选 (c) 单细胞/单细胞核捕获

