一、背景介绍
克隆形成实验是研究细胞存活率并探讨单个细胞增殖潜能的有效方法之一。
即在体外培养环境下,通过使单个细胞经过连续分裂繁殖至少6代,形成的细胞集群被称为克隆或集落。
每个克隆的尺寸通常在0.3-1.0mm之间,含有50个以上的细胞。通过计算克隆形成率,能够对单个细胞的增殖潜力进行量化分析。
1.用途:
(1)评估细胞增殖能力:克隆形成实验可以帮助研究人员评估细胞的增殖潜力。通过观察和计数形成的独立克隆,可以了解细胞在体外环境中的增殖速率和能力。
(2)研究细胞群体依赖性:克隆形成实验有助于了解细胞的群体依赖性,即细胞是否需要相互合作形成克隆。这对于理解细胞群体内的相互作用和细胞信号传导至关重要。
(3)筛选药物和治疗方案:克隆形成实验可用于评估药物对细胞增殖的影响。通过在实验前后比较克隆形成率,研究人员可以评估潜在药物或治疗方案的疗效。
2.常用的手段有两个:
①平板克隆形成实验:通过将细胞培养于培养基中,主要适用于贴壁生长的细胞,以评估细胞的克隆形成能力。
②软琼脂克隆形成实验:通过将细胞悬浮于含琼脂糖的培养基中,主要用于评估贴壁和悬浮的肿瘤细胞或转化细胞系的克隆形成潜能。
二、平板克隆形成实验的实验步骤
(1) 从细胞处于对数生长期状态开始,通过胰酶消化将细胞完全悬浮于完全培养基中,并进行准确计数;
(2) 在每个实验组中,控制细胞数量在400-1,000个细胞/孔的范围内(对于不同的细胞类型,需要进行预实验以确定最佳细胞数量),并接种于6孔板;
(3) 持续培养至14天,或直到大多数单个克隆中的细胞数超过50个。在培养过程中,每隔3天更换培养基,并观察细胞状态;
(4) 克隆形成完成后,使用1 mL 4%多聚甲醛进行细胞固定,固定时间为15-30分钟。最后,用PBS洗涤;
(5) 向每个孔中加入1 mL结晶紫染液,染色时间控制在10-20分钟内;
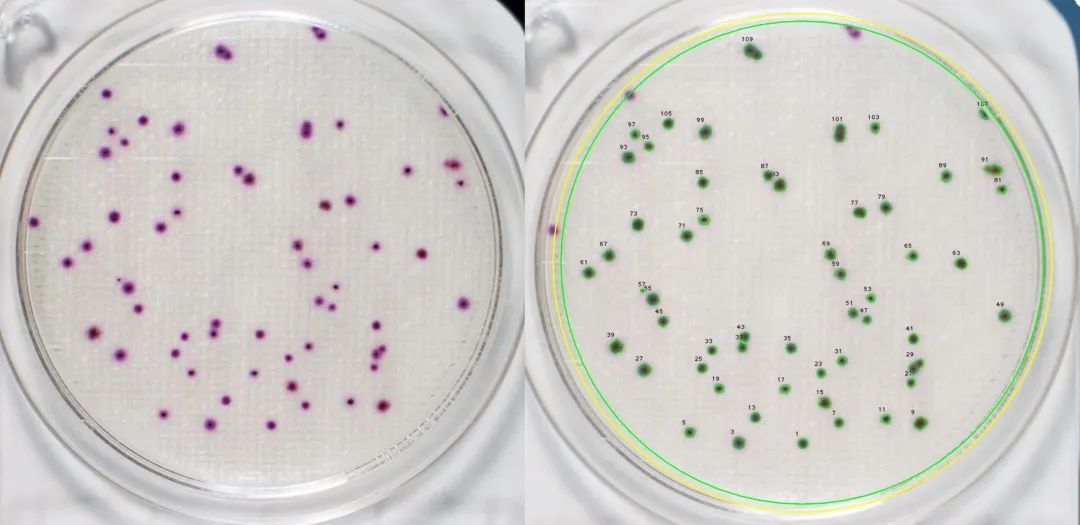
(6) 利用PBS进行多次细胞洗涤,进行拍照(分别对整个六孔板及每个孔进行单独拍照)。
注意:本实验的成功关键在于细胞悬液的制备和适度的接种密度,务必确保细胞均匀分散,防止细胞团的形成,并谨慎确保接种密度不过于密集。

三、软琼脂克隆形成实验的实验步骤
(1)制备细胞悬液:从正处于对数生长期的细胞中,进行消化后,通过离心将细胞沉淀收集。随后,重悬细胞,进行计数,并可以按需倍比稀释至1×10^3个/mL。
(2)配置琼脂:利用蒸馏水制备两个不同浓度的低熔点琼脂糖溶液,浓度分别为1.2%和0.7%。实验前需高压灭菌,并在40℃水浴中放置以防止凝固。按照1:1的比例混合1.2%琼脂糖和2×DMEM培养基,取1.5 mL加入6孔板中。经冷却凝固后,形成底层琼脂,可将其储存于培养箱中备用。
(3)接种细胞:以1:1的比例混合0.7%琼脂糖和2×DMEM培养基(含20%的胎牛血清)于无菌管中,接着将0.2mL的细胞悬液加入到混合液。充分混匀后,将此混合液加入到带有1.2%琼脂糖底层的孔板中,形成双层琼脂结构,最后,添加一层培养基以防止琼脂干燥,为细胞提供额外的养分,放置于工作台1h左右使其凝固。
(4)待上层琼脂凝固后,将培养皿置于37℃、5% CO2的温箱中培养10~14天。
(5)将培养皿放置在倒置显微镜下,观察细胞克隆数,并计算形成率。
注意事项:
(1)试验中琼脂与细胞相混时,琼脂温度不宜超过40℃,以确保细胞生长不受影响;
(2)在进行细胞接种时,务必确保细胞悬液充分混匀;
(3)在培养过程中,需关注培养基的颜色,定期更换培养基,并仔细观察是否存在污染迹象;
(4)细胞铺板时密度不能太大,实验过程中速度要快,防止局部结块。

